REAKSI KIMIA DAN ANALISIS ASAM AMINO
1.Analisa asam Amino
Analisa asam amino terbagi menjadi 2 yaitu :
- Analisa kualitatif
- Analisa kuantitatif
Analisa
kualitatif adalah suatu analisa yang bersifat induktif dan
berkelanjutan yang tujuan akhirnya menghasilkan pengertian-pengertian,
konsep-konsep dan pembangunan suatu teori baru.Atau dengan kata lain
analisa kualitatif adalah analisa berdasarkan apa yang kita lihat atau
kita amati. Misalnya uji asam amino dalam sampel makanan dengan
menggunakan reaksi spesifik ninhidrin. Lalu mengamati warna-warna yang
dihasilkan dari percobaan pengamatan tersebut. Untuk hasil positif
mengandung asam amino yaitu menghasilkan warna ungu.Hasil warna
merupakan hasil analisa kualitatif.
Analisa
kuantitatif adalah suatu analisa yang bersifat deduktif, uji empiris
teori yang dipakai dan dilakukan setelah selesai pengumpulan data secara
tuntas dengan menggunakan sarana statistic. Misalnya untuk menjawab
pertanyaan berapa kadar asam amino yang terkandung dalam sampel makanan
tersebut ? . Penentuan kadar merupakan analisa kuantitatif.
Tahap pertama dalam menentukan struktur suatu protein
tertentu adalah dengan menghirolisa protein itu menjadi komponen asam
amino nya , lalu menentukan jumlah tiap- tiap asam amino. Untuk
memisahkan, mengidentifikasi dan mengukur secara kuantitatif jumlah
tiap- tiap asam amino di dalam campuran, diperlukan metoda yang dapat
mempermudah hal ini, terutama elektroforesis dan khromatografy penukaran
ion . Kedua metoda ini memanfaatkan perbedaan dalam tingkah laku
asam-basa dari asam amino yang berbeda , yakni perbedaan dalam tanda dan
besar muatan listrik total pada pH tertentu, yang dapat diduga dari
nilai pK’ dan kurva titrasi.
Namun masih terdapat lagi metoda kromatografi yang dapat digunakan
dalam melakukan uji kualitatif asam amino yaitu kromatografi kertas dan
kromatografi lapis tipis. Namun untuk kromatogarafi lapis tipis dan
kromatografi penukaran ion juga termasuk kedalam analisa kuantitatif.
Elektroforesis Kertas Memisahkan Asam- Amino Berdasarkan Muatan Listrik
Metoda yang paling sederhana untuk memisahkan asam amino adalah elektroforesis kertas.
Setetes larutan dari campuran asam amino ditempatkan pada selembar
kertas filter yang telah dibasahi oleh buffer pada pH tertentu. Medan
listrik dengan tegangan tinggi diberikan pada kertas tersebut. Karena
perbedaan nilai pK’,
asam amino akan bermigrasi menuju arah yang berbeda dan pada kecepatan
yang berbeda disepanjang kertas, tergantung pada pH system buffer dan
tegangan listrik yang dipergunakan . Contoh nya pada pH 1,0, histidin,
arginin, dan lisin mempunyai muatan +2 dan bergerak lebih cepat menuju
katoda bermuatan negative dibandingkan dengan asam amino lainnya yang
mempunyai muatan +1. Pada pH 6,0 , asam amino bermuatan positif (lisin,
arginin, histidin)bergerak menuju katoda , dan asam amino bermuatan
negative (asam aspartat dan asam glutamate) menuju anoda. Semua asam
amino lain akan tinggal pada atau dekat titik asal, karena senyawa ini
tidak mempunyai gugus mengion selain dari gugus α-amino dan α-karboksil,
dan karenanya , mempunyai titik isoelektrik yang hampir sama seperti
ditentukan dari nilai pK’1 dan pK’2 . Untuk menetapkan letak asam amino pada kertas, dilakukan pengeringan dan penyemprotan dengan nihidrin dan pemanasan. Spot warna biru atau ungu, masing- masing menunjukkan adanya asam amino, akan muncul pada kertas. Kromatografi Penukar Ion Merupakan Proses pemisahan yang Lebih Berguna
Kromatografi penukar ion merupakan metoda yang paling banyak digunakan untuk memisahkan, mengidentifikasi dan menghitung jumlah tiap-tiap asam amino didalam suatu campuran . Metoda ini memanfaatkan perbedaan dalam tingkah laku asam-basa dari asam amino. Kolom kromatografi terdiri dari tabung panjang yang diisi dengan granula resin sintetik yang mengandung gugus yang bermuatan tetap. Resin dengan gugus anion tertentu disebut resin penukar kation,resin dengan gugus kation tertentu disebut resin penukar anion . dalam bentuk kromatografi penukar ion yang paling sederhana , asam amino dapat dipisahkan pada kolom resin penukar kation. Dalam hal ini, gugus anion terikatnya, misalnya gugus asam sulfonat (‒SO3- ), pertama-tama diberi bermuatan dengan Na+. Larutan asam (pH 3,0 ) dari campuran asam amino yang akan dianalisa dituangkan ke dalam kolom dan dibiarkan tersaring secara berlahan-lahan. Pada pH 3,0 sebagian besar asam amino berbentuk kation dengan muatan total positif, tetapi senyawa ini berbeda didalam tingkat mengionnya. Pada saat campuran mengalir melalui kolom, asam amino bermuatan positif akan menukar ion Na+, yang berikatan dengan gugus tetap ‒SO-3 pada partikel resin. Pada pH 3,0 asam amino yang bermuatan paling positif ( lisin, arginindan histidin) akan menukar Na+, pertama-tama dari resin, lalu akan terikat paling kuat pada resin.
Asam amino yang pada pH 3,0 bermuatan positif paling kecil ( asam glutamat dan asam aspartat) akan terikat paling lemah. Semua asam amino yang lain akan mempunyai muatan positif diantara kedua ekstrim. Asam amino yang berbeda , akan bergerak ke bawah kolom resin pada kecepatan yang berbeda , yang tergantung terutama pada nilai pK’, tetapi juga sebagian bergantung pada adsorpsi atau kelarutannya di dalam partikel resin. Asam glutamat dan aspartat akan bergerak ke bawah kolom pada kecepatan paling tinggi , karena ikatan senyawa ini dengan resin paling lemah pada pH 3,0 sedangkan lisin, arginin, dan histidin akan bergerak paling lambat . Fraksi- fraksi kecil pada beberapa milliliter, masing- masing akan dikumpulkan dari bagian bawah kolom dan dianalisa secara kuantitatif . Seluruh prosedur tlah di otomasikan, sehingga pencucian, pengumpulan fraksi, analisa tiap fraksi , dan pencatatan data dilakukan secara otomatis didalam analisa asam amino.
Gambar dibawah ini memperperlihatkan kromatografi dari campuran asam amino

Gambar.kromatografi kolom
Kromatografi kertas sebagai penyerap digunakan sehelai kertas dengan susunan serabut dan tebal yang sesuai. Mekanisme pemisahan dengan kromatografi kertas prinsipnya sama dengan mekanisme pada kromatografi kolom. Adsorben dalam kromatografi kertas adalah kertas saring, yakni selulosa. Sampel yang akan dianalisis ditotolkan ke ujung kertas yang kemudian digantung dalam wadah. Kemudian dasar kertas saring dicelupkan kedalam pelarut yang mengisi dasar wadah. Fasa mobil (pelarut) dapat saja beragam. Air, etanol, asam asetat atau campuran zat-zat ini dapat digunakan.
Kromatografi kertas diterapkan untuk analisis campuran asam amino dengan sukses besar. Karena asam amino memiliki sifat yang sangat mirip, dan asam-asam amino larut dalam air dan tidak mudah menguap (tidak mungkin didistilasi), pemisahan asam amino adalah masalah paling sukar yang dihadapi kimiawan di akhir abad 19 dan awal abad 20. Jadi penemuan kromatografi kertas merupakan berita sangat baik bagi mereka.
Kromatografi kertas dua-dimensi (2D) menggunakan kertas yang luas bukan lembaran kecil, dan sampelnya diproses secara dua dimensi dengan dua pelarut.
Kromatografi lapis tipis
digunakan untuk memisahkan komponen-komponen atas dasar perbedaan
adsorpsi atau partisi oleh pase diam dibawah gerakan pelarut pengembang.
Pada dasarnya KLT sangat mirip dengan kromatografi kertas , terutama
pada cara pelaksanaannya. Perbedaan nyatanya terlihat pada fase diamnya
atau media pemisahnya, yakni digunakan lapisan tipis adsorben sebagai
pengganti kertas.
Bahan
adsorben sebagai fasa diam dapat digunakan silika gel, alumina dan
serbuk selulosa. Partikel selika gel mengandung gugus hidroksil pada
permukaannya yang akan membentuk ikatan hidrogen dengan molekul polar
air. Fase diam untuk kromatografi lapis tipis seringkali juga mengandung
substansi yang mana dapat berpendarflour dalam sinar ultra violet. Fase
gerak merupakan pelarut atau campuran pelarut yang sesuai.
- REAKSI KIMIA SPESIFIK ASAM AMINO
Reaksi asam amino mencirikan gugus fungsional yang terkandung. Semua asam amino mengandung gugus aminodan karboksil. Senyawa ini akan memberikan reaksi kimia yang mencirikan gugus-gugus ini . Sebagai contoh , gugus amino dapat memberikan reaksi asetilasi dan gugus karboksil esterifikasi.
- REAKSI GUGUS KARBOKSIL
- Gugus karboksil suatu asam amino dapat membentuk ester dengan adanya alcohol
- Dalam
sebuah molekul protein, gugus karboksil suatu asam amino berikatan
dengan gugus amino dari asam amino lainnya melalui ikatan peptida.
Dalam sel hidup, sintesisikatan peptida ini melalui jalan yang rumit, namun untuk mudahnya dapat digambarkan sebagai berikut :
Suatu peptida yang terdiri dari dua atau lebih ikatan peptida bereaksi dengan Cu2+ dalam
larutan basadan membentuk kompleks berwarna biru- ungu. Reaksi ini
dikenal dengan sebagai reaksi Biuret, dan merupakan dasar dari penentuan
protein secara kuantitatif.
- Dekarboksilasi gugus karboksil
Gugus
karboksil asam amino dapat terdekarboksilasi baik secara kimia maupun
secara biologis sehingga terbentuk amina. Contohnya adalah pembentukan
histamin dan histidin. Histamin merangsang pengaliran cairan gastrium ke
usus besar dan terlibat dalam reaksi alergi.
- REAKSI GUGUS AMINA
- Reaksi dengan HNO2
Gugus amina dapat bereaksi dengan zat pengoksidasi kuat HNO2 untuk melepaskan N2 yang kemudian dapat ditentukan secara manomerik.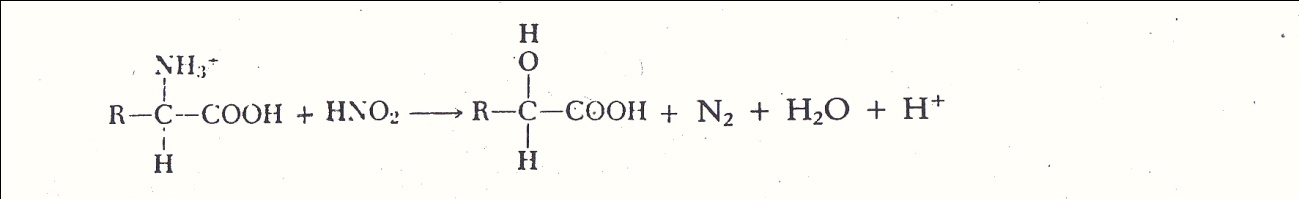
Reaksi
ini dipakai untuk perkiraan jumlah gugus α-amina yang terdapat pada
asam amino, peptida , atau protein. Tetapi asam amino prolin dan
hidroksil prolintidak dapat bereaksi dengan HNO2
sedangkan gugus α-amina pada lisin hanya dapat bereaksi secara lamban .
Reaksi ini menjadi dasar dari cara penentuan protein kasar pada metoda
Kjeldahl.
- Reaksi nindidrin
Gugus amina dapat bereaksi dengan pereaksi ninhidrin membentuk amonia , CO2,
dan aldehida. Reaksi ninhidrin dipakai sebagai dasar untuk penentuan
kuantitas asam amino. Warna biru menunjukkan secara khas gugus amino.
Tetapi prolin dan hidroksi prolin yang mempunyai gugus amina sekunder
menghasilkan warna kuning. Sedang asparagin yang mengandung gugus amida
bebas bereaksi membentuk warna cokelat. pada kondisi yang sesuai
intensitas warna yang dihasilkan dapat dipergunakan untuk mengukur
konsentrasi asam amino secara kalorimetrik. Metoda ini sangat sensitif
pada pengukuran konsentrasi.
- Reaksi dengan 1-fluoro-2,4-dinitrobenzena ( FDNB )
Dalam
reaksi ini terbentuk derivat asam amino 2,4-dinitrofenil yang berwarna
kuat. Senyawa FDNB bereaksi dengan gugus aminoyang bebas pada ujung NH2- terminal suatu polipeptida , dengan gugus E-amino dari asam amino lisin begitu juga gugus amino dalam asam amino bebas. Alian
- Reaksi dengan dansil klorida
Gugus amina pada asam amino atau pada peptida bereaksi dengan dansil klorida ( 1-dimetilaminonaftalen klorida )
membentuk derivat asam amino dansil. Gugus dansil ini berfluoresensi
sehingga asam amino yang sangat sedikit dapat ditentukan dengan cara
ini.
- Reaksi dengan formal dehida ( Sӧrenson formal titration )
Formaldehida
menutup gugus amino dan membentuk kompleks asam amino formaldehida,
sehingga gugus karboksilnya yang bebas dapat didititrasi. Indikator yang
dipakai adalah fenolftalein dan timolftalein.
- Diantara reaksi gugus aminoyang sangat penting adalah reaksi yang ditemukan oleh Edman. Dia telah mencoba memodifikasi reaksi isotianat dengan amina demikian rupa sehingga modifikasi ini dapat dipakai untuk degradasi rantai polipeptida dan untuk identifikasi terminal –NH2 pada peptida. Dalam prosedur edman ini, fenilisotiosianat bereaksi dengan α-asam amino membentuk asam amino feniltiokarbamoil. Jika diberi larutan nitrometan, asam amino feniltiokarbamoilberubah menjadi bentuk siklik yaitu feniltiohidantoin. Senyawa ini tidak berwarna, dapat dipisahkan dengan mudah dan kemudian diidentifikasikan dengan kromatografi. Reaksi edman sering digunakan untuk identifikasi terminal NH2 asa amino suatu polipeptida.
- REAKSI GUGUS R
Beberapa
asam amino mempunyai gugus R yang dapat mengion. Contohnya ialah
sistein, tirosin, dan histidin. Reaksi lain yang sangat penting adalah
secara biologis ialah reaksi gugus R pada serin dan sistein.
Gugus
–SH pada sistein juga dapat bereaksi secara aktif, misalnya pada
pembentukan asam amino sistin. Ikatan disulfida yang berasal dari gugus
–SH sistein banyak terdapat dalam protein. Misalnya pada molekul insulin
yang aktif ada 3 ikatan disulfida dimana 2 diantaranya menjadi
jembatan antara 2 rantai polipeptida. Enzim ribonukleasemempunyai 4
ikatan disulfide antara 4 pasang residu sistein dan kalau ikatan ini
rusak maka enzim menjadi tidak aktif
Permasalah
1.jelaskan kegunaan dari protein sehari-hari?
2. Seberapa penting protein dalam tubuh kita?
3. Jelaskan perbedaan reaksi sakaguchi dan metode buret? sesuai yang anda ketahui.
4. Jelaskan apa yang dimaksud dengan ikatan disulfida?
Sumber:
(Aisjah girindra.1990.hal:73-76)
http://pisassakienah.wordpress.com/2009/10/09/kromatografi/)
(Lehninger.1982.hal:122-125)
http://kimia-master.blogspot.co.id/2011/11/reaksi-kimia-dan-analisis-asam-amino-1.html
Baiklah, saya desi ratna sari menjawab permasalahan nomor 1, Fungsi Utama Protein Dalam Kehidupan Sehari-hari
BalasHapusFungsi utama protein adalah untuk
pembentukan otot dan sel-sel di dalam tubuh. Protein ini nanti akan menjadi makanan untuk otot agar tetap tumbuh berkembang. Apabila otot yang terbentuk tetap terpelihara dengan baik, maka ia akan membantu tubuh memaksimalkan pembakaran lemak sehingga berat badan tetap seimbang.
Manfaat Protein Bagi Tubuh Manusia
1. Sebagai enzim
Protein memiliki peranan yang besar untuk mempercepat reaksi biologis.
2. Sebagai alat pengangkut dan penyimpan.
Protein yang terkandung daam hemoglobin dapat mengangkut oksigen dalam eritrosit.Protein yang terkandung dalam mioglobin dapat mengangkut oksigen dalam otot.
3. Untuk penunjang mekanis
Salah satu protein yang berbentuk serabut yang disebut kolagen memiliki fungsi untuk menjaga kekuatan dan daya tahan tulang dan kulit.
4. Sebgai pertahanan tubuh dan imunisasi pertahanan tubuh
Proteun ini biasa digunakan dalam bentuk antibodi
5. Sebaga Media perambatan impuls syaraf
6. Sebagai pengendalian pertumbuhan
Jika kekurangan protein,bisa menyebabkan terganggunya pertumbuhan pada anak-anak.
7. Membentuk jaringan pada tubuh dengan kandungan asam aminonya
8. Mencegah penyakit kwashiorkor dan marasmus
Dimana kedua penyakit ini diakibatkan oleh kekurangan protein.
9. Asupan protein yang cukup juga dapat membantu dalam proses penyembuhan luka, regenerasi sel hingga mengatur kerja hormon dan enzim dalam tubuh.
Saya demiati akan menjawab pertanyaan no2 yang Mana protein berperan penting untuk tubuh yaitu seperti membuat kita bisa bergerak dengan leluasa, mendistribusikan oksigen ke seluruh tubuh, membekukan darah saat kita terluka, melawan infeksi, mengangkut zat masuk dan keluar dari sel, mengendalikan reaksi kimia, dan membawa pesan dari satu bagian tubuh ke tubuh lainnya.
BalasHapusNama saya dolla mulyana harnas dengan nim a1c116080 akan mencoba menjawab nomor 3 Reaksi sakaguchi pada uji protein digunakan untuk mengetahui Kandungan protein dalam tubuh manusia sedangkan metode buret digunakan untuk melakukan titrasi atau mengetahui titik akhir.
BalasHapusSaya alan mencoba menjawab pertanyaan keempat ikatan disulfida yaitu ikatan antara dua residu sistein dalam rantai polipeptida yang sama maupun dalam rantai polipeptida yang berbeda. Ikatan -S-S- berperan penting dalam menstabilkan pembentukkan konformasi protein ekstraseluler, contohnya pada hormon insulin
BalasHapus